Publi¨¦ le 6 juin 2019 – Mis ¨¤ jour le 7 juin 2019
Un texte de la Minute Recherche par Philippe Arnaud (GReD, unit¨¦ mixte de recherche Inserm / CNRS / Universit¨¦ Clermont Auvergne) et Marc Berger (unit¨¦ CHELTER).
La Leuc¨¦mie Myeloide Chronique (LMC) est un cancer du sang et de la moelle osseuse. C¡¯est l¡¯un des rares cas de transformation maligne due ¨¤ un seul ¨¦v¨¨nement : une translocation entre les chromosomes 9 et 22 conduisant au rapprochement et ¨¤ la fusion aberrante des g¨¨nes ABL et BCR. Il en r¨¦sulte la production d¡¯une prot¨¦ine dite ? chim¨¨re ?, BCR-ABL1 dans laquelle l¡¯activit¨¦ enzymatique ? tyrosine kinase ? de ABL1 est d¨¦brid¨¦e, ce qui va conduire au d¨¦veloppement de la LMC. De fait, des strat¨¦gies th¨¦rapeutiques bas¨¦es sur l¡¯utilisation d¡¯inhibiteurs de tyrosine kinase (ITKs) ont fait leur preuve pour le traitement de cette pathologie.
Toutefois, plusieurs observations cliniques d¨¦montrent l¡¯existence d¡¯une sous-population de cellules r¨¦sistantes aux ITKs. En particulier, les cellules souches leuc¨¦miques qui coexistent dans la moelle osseuse avec les cellules malignes plus diff¨¦renci¨¦es, seraient capables de survivre malgr¨¦ les traitements ITKs, et ainsi entrainer des rechutes.
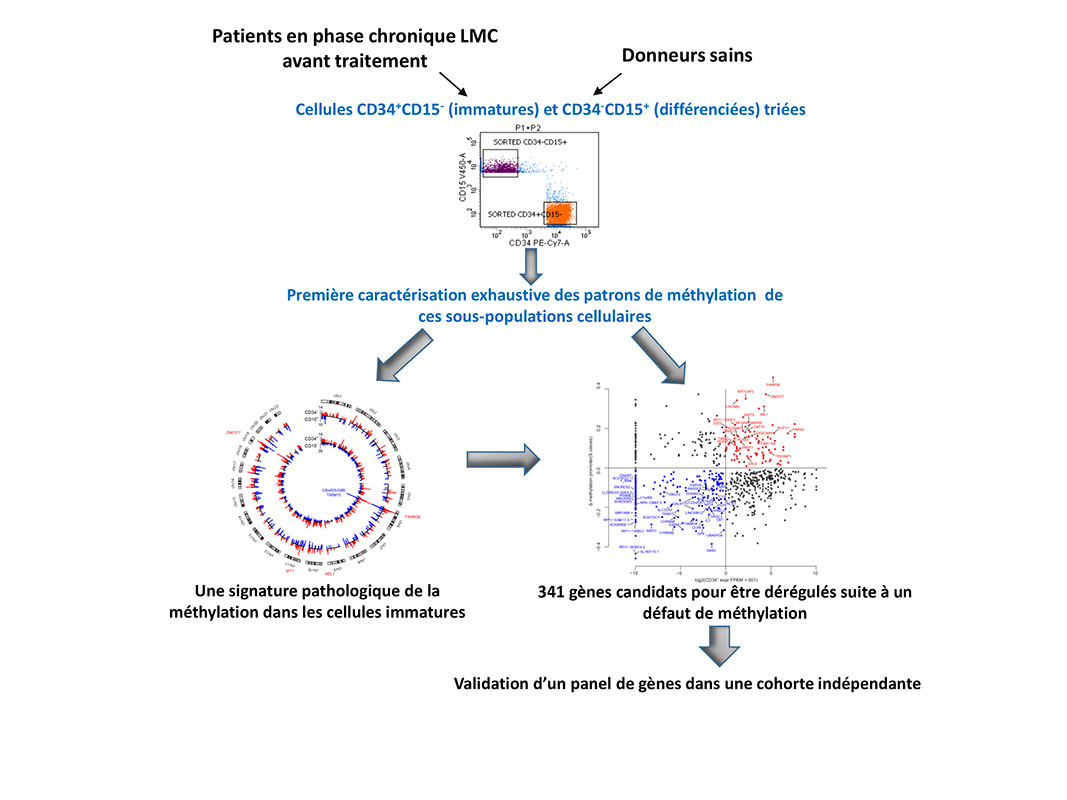
Parmi les m¨¦canismes sous-jacents possibles, la m¨¦thylation, qui est une modification chimique se portant directement sur la mol¨¦cule d¡¯ADN, ¨¦merge, de par ses caract¨¦ristiques, comme un candidat pertinent. Le d¨¦veloppement normal repose en effet sur le d¨¦p?t contr?l¨¦ de cette modification sur un ensemble de r¨¦gions r¨¦gulatrices. De fait une alt¨¦ration dans ce processus entraine des d¨¦fauts dans le programme d¡¯expression des g¨¨nes et conduit ¨¤ des pathologies. Pour autant, et alors qu¡¯une telle perturbation des patrons de m¨¦thylation est d¨¦crite dans de nombreux cancers, cette modification ¨¦pig¨¦n¨¦tique reste largement sous-¨¦tudi¨¦e dans la LMC. Sur ce constat, les auteurs ont r¨¦alis¨¦ la premi¨¨re ¨¦tude exhaustive du patron de m¨¦thylation lors des phases pr¨¦coces de la LMC et ce avant traitement.
Suite ¨¤ un tri cellulaire rigoureux, deux populations cellulaires ont ¨¦t¨¦ isol¨¦es sur les m¨ºmes patients lors de la phase chronique de la maladie : une de cellules immatures, enrichie en cellules souches leuc¨¦miques, et une compos¨¦e de cellule diff¨¦renci¨¦es, et le patron de m¨¦thylation ¨¦tabli pour chacune de ces populations. Cette approche a permis de r¨¦v¨¦ler une signature ? pathologique ? de la m¨¦thylation sp¨¦cifique des cellules immatures et d¡¯identifier plus de 300 g¨¨nes candidats, dont un panel a ¨¦t¨¦ valid¨¦, pour avoir une expression alt¨¦r¨¦e suite ¨¤ un d¨¦faut de m¨¦thylation.
Cette ¨¦tude est la premi¨¨re ¨¤ mettre en ¨¦vidence l¡¯implication de la m¨¦thylation de l¡¯ADN dans l¡¯h¨¦t¨¦rog¨¦n¨¦it¨¦ intra-clonale lors de la phase chronique de la maladie. De plus, elle fournit une ressource unique, ouvrant de nouvelles perspectives pour d¨¦terminer les bases mol¨¦culaires de la r¨¦sistance au traitement.
Autres laboratoires partenaires
- H¨¦matologie Biologique, CHU Clermont-Ferrand, H?pital Estaing, Clermont-Ferrand Cedex 1, France.
- Equipe d'Accueil 7453 CHELTER, Universit¨¦ Clermont Auvergne, CHU Clermont-Ferrand, H?pital Estaing, Clermont-Ferrand Cedex 1, France.
- H¨¦matologie Clinique, CHRU Nancy, H?pitaux de Brabois, Vandoeuvre-l¨¨s-Nancy, France.
- H¨¦matologie Clinique, CH Annecy-Genevois, Epagny Metz-Tessy, France.
- Institut d'H¨¦matologie de Basse Normandie, CHU de Caen, Caen Cedex 9, France.
- H¨¦matologie Clinique, Institut Bergoni¨¦, Bordeaux Cedex, France.
- Centre Hospitalier de Versailles, service d'H¨¦matologie et d'Oncologie, Le Chesney, France.
- D¨¦partement d'H¨¦matologie, Institut de Canc¨¦rologie Lucien Neuwirth, Saint-Priest-en-Jarez, France.
- CRB-Auvergne, CHU Clermont-Ferrand, H?pital Estaing, Clermont-Ferrand Cedex 1, France.


