Une serrure ¨¤ double combinaison pour neutraliser les g¨¨nes sauteurs
Des chercheurs de l¡¯iGReD (UCA/CNRS/Inserm), en collaboration avec l¡¯Universit¨¦ de Cambridge, ont mis au jour un nouveau m¨¦canisme ¨¦pig¨¦n¨¦tique permettant de contr?ler les ? g¨¨nes sauteurs ?, des ¨¦l¨¦ments d¡¯ADN mobiles dont l¡¯activit¨¦ peut menacer l¡¯int¨¦grit¨¦ du g¨¦nome.
Les ¨¦l¨¦ments transposables, parfois surnomm¨¦s ? g¨¨nes sauteurs ?, sont des morceaux d¡¯ADN capables de se d¨¦placer d¡¯un endroit ¨¤ un autre dans le g¨¦nome. Pr¨¦sents chez presque tous les ¨ºtres vivants, ces ¨¦l¨¦ments ont jou¨¦ un r?le dans l¡¯¨¦volution, mais ils peuvent aussi devenir dangereux : en bougeant, ils risquent de casser ou perturber le fonctionnement normal de l¡¯ADN. Cela peut provoquer des mutations, alt¨¦rer certains g¨¨nes et favoriser le d¨¦veloppement de maladies comme certains cancers.
Le risque est encore plus grand quand ces ¨¦l¨¦ments s¡¯activent dans les cellules germinales (celles qui donnent les ovules ou les spermatozo?des), car les anomalies peuvent alors ¨ºtre transmises ¨¤ la descendance.
Pour mieux comprendre comment ces ? g¨¨nes sauteurs ? sont contr?l¨¦s, des chercheurs de l¡¯Institut de G¨¦n¨¦tique, Reproduction et D¨¦veloppement (iGReD, UCA/CNRS/Inserm), en collaboration avec l¡¯Universit¨¦ de Cambridge, ont utilis¨¦ la mouche drosophile comme mod¨¨le. Ils ont d¨¦couvert un nouveau m¨¦canisme ¨¦pig¨¦n¨¦tique ¨C une forme de r¨¦gulation qui n'alt¨¨re pas l¡¯ADN lui-m¨ºme mais contr?le son activit¨¦ ¨C permettant de freiner ces ¨¦l¨¦ments mobiles.
Ces r¨¦sultats ont ¨¦t¨¦ publi¨¦s dans la revue Nature Structural and Molecular Biology.
Chez la drosophile, les cellules germinales utilisent un syst¨¨me de d¨¦fense sp¨¦cifique, conserv¨¦ de l¡¯¨¦ponge de mer jusqu¡¯¨¤ l¡¯homme, appel¨¦ la voie des piARNs, pour emp¨ºcher l¡¯expression des ¨¦l¨¦ments transposables (ET). Cette voie repose sur des ARNs de petite taille et des prot¨¦ines sp¨¦cialis¨¦es, dont Rhino chez la drosophile, une prot¨¦ine essentielle ¨¤ la production des piARNs et ¨¤ la r¨¦pression des ET. Sans Rhino les piARNs ne sont pas produits et le contr?le des ETs est perdu. Rhino, une prot¨¦ine de la famille HP1, est connue pour se lier ¨¤ certaines r¨¦gions du g¨¦nome enrichies en H3K9me3, une marque ¨¦pig¨¦n¨¦tique associ¨¦e ¨¤ l¡¯h¨¦t¨¦rochromatine. Toutefois, il restait ¨¤ comprendre pourquoi elle ne se fixait qu¡¯¨¤ une sous fraction des r¨¦gions portant cette marque.
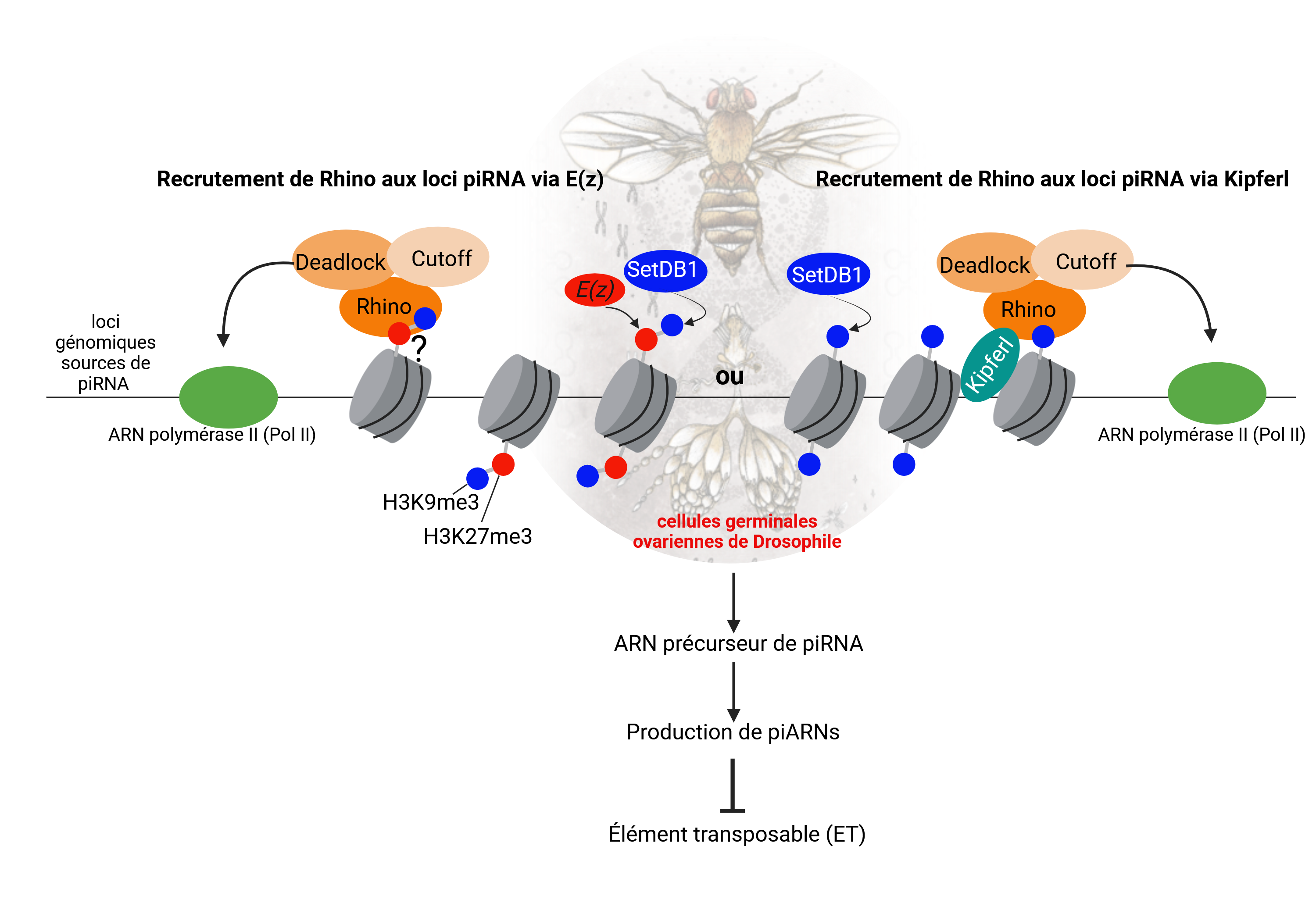
Pour r¨¦pondre ¨¤ cette question, les chercheurs ont identifi¨¦ un nouveau m¨¦canisme impliquant une seconde marque ¨¦pig¨¦n¨¦tique, H3K27me3, catalys¨¦e par l¡¯enzyme Enhancer of Zeste (Ez). Cette marque, co-localis¨¦e avec H3K9me3 sur certains loci sp¨¦cifiques, forme un "code ¨¦pig¨¦n¨¦tique double" qui guide Rhino vers ces r¨¦gions g¨¦nomiques pr¨¦cises, les transformant en site de production de piARNs. De mani¨¨re inattendue, ils ont ¨¦galement montr¨¦ que ce m¨¦canisme fonctionne ind¨¦pendamment de Kipferl, une autre prot¨¦ine qui joue un r?le dans le ciblage de Rhino sur d¡¯autres r¨¦gions.
Pour tester leurs hypoth¨¨ses, les chercheurs ont utilis¨¦ une combinaison d¡¯approches g¨¦n¨¦tiques, d¡¯imagerie et de s¨¦quen?age haut d¨¦bit. Leurs r¨¦sultats montrent que l¡¯absence d¡¯E(z) et de H3K27me3 perturbe la fixation de Rhino sur certains loci, entra?nant une r¨¦duction de la production de piRNA et une augmentation aberrante de l¡¯activit¨¦ des ETs dans les cellules germinales.
Ces travaux soulignent l¡¯importance des m¨¦canismes ¨¦pig¨¦n¨¦tiques dans le maintien de la stabilit¨¦ g¨¦nomique. En combinant deux marques ¨¦pig¨¦n¨¦tiques distinctes, les cellules germinales de la drosophile utilisent une strat¨¦gie sophistiqu¨¦e pour ¨¦tiqueter sp¨¦cifiquement les ¨¦l¨¦ments transposables et les r¨¦primer de mani¨¨re efficace. Ce m¨¦canisme est non seulement crucial pour la drosophile, mais il pourrait ¨¦galement ¨ºtre conserv¨¦ dans d¡¯autres esp¨¨ces, soulignant son r?le fondamental.
En conclusion, cette ¨¦tude met en lumi¨¨re un exemple remarquable d¡¯interaction entre plusieurs marques ¨¦pig¨¦n¨¦tiques pour orchestrer la d¨¦fense du g¨¦nome contre les ¨¦l¨¦ments transposables. Ces d¨¦couvertes ouvrent de nouvelles perspectives pour comprendre comment les modifications de la chromatine r¨¦gulent la dynamique des g¨¦nomes au cours du d¨¦veloppement et de l¡¯¨¦volution.
? Emilie Brasset
Ce travail a ¨¦t¨¦ r¨¦alis¨¦ en collaboration avec le laboratoire de Greg Hannon au CRUK ¨¤ Cambridge
Contact chercheuse :
Emilie Brasset
Enseignant Chercheur
emilie.brasset@uca.fr
iGReD (UCA/CNRS/Inserm)
Facult¨¦ de M¨¦decine
28 Place Henri Dunant, 63001 Clermont-Ferrand
