D¨¦termination de la structure d¡¯une subtilase autotransporteur : Vers une meilleure compr¨¦hension des prot¨¦ases bact¨¦riennes du tractus gastro-intestinal et des ¨¦cosyst¨¨mes alimentaires
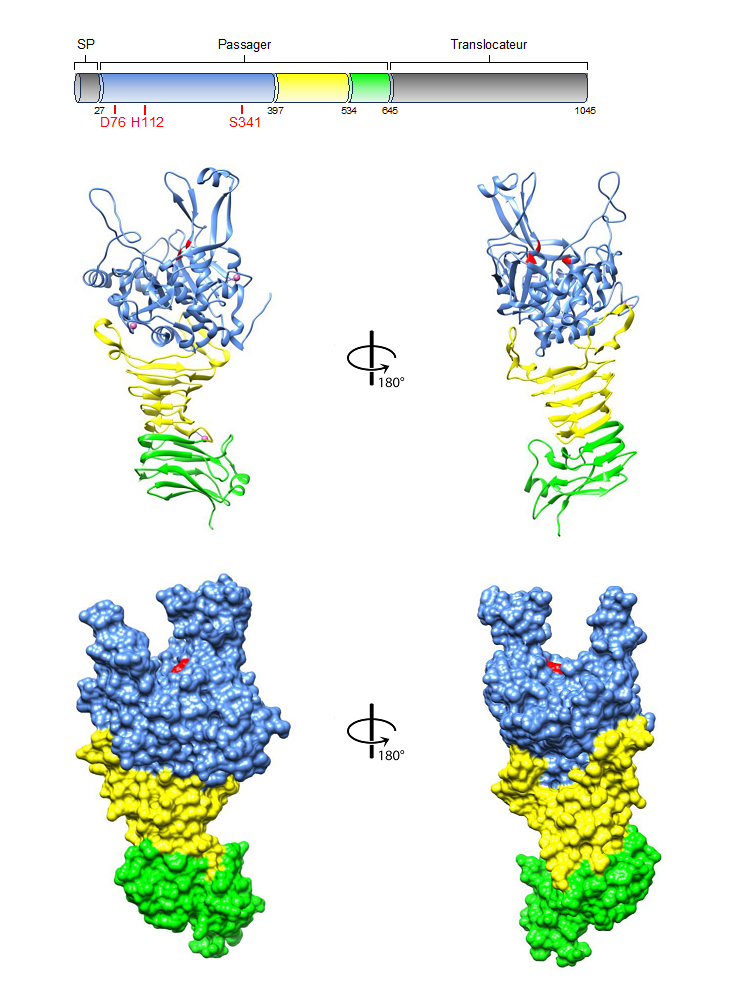
Dans le cadre d¡¯une collaboration avec The Institute for Molecular Science, La Trobe University (Australie) et l¡¯UMR MEDIS, une nouvelle structure de prot¨¦ase bact¨¦rienne appartenant ¨¤ la famille des SATs (subtilase autotransporters) a ¨¦t¨¦ publi¨¦e dans le journal Nature Communications, ce travail contribuant ¨¤ une meilleure compr¨¦hension du r?le des prot¨¦ases bact¨¦riennes dans le tractus gastro-intestinal animal, humain ou d¡¯autres ¨¦cosyst¨¨mes de la cha?ne alimentaire.
Au niveau du tractus gastro-intestinal (TGI), de nombreuses prot¨¦ases interviennent dans la d¨¦gradation des prot¨¦ines alimentaires mais aussi dans la r¨¦ponse immunitaire. Tandis que le r?le des prot¨¦ases humaines dans le maintien de l'hom¨¦ostasie du TGI est bien connu, les prot¨¦ases bact¨¦riennes peuvent aussi intervenir dans diff¨¦rents types d¡¯interactions microbiennes et contribuer au d¨¦veloppement d¡¯¨¦tats physiopathologiques, notamment lors d¡¯infections par des pathog¨¨nes. Les bact¨¦ries peuvent s¨¦cr¨¦ter une grande vari¨¦t¨¦ de prot¨¦ases, notamment de la famille des autotransporteurs (ATs) chez les bact¨¦ries ¨¤ Gram n¨¦gatif. Sur les deux grandes familles de prot¨¦ases empruntant le syst¨¨me de s¨¦cr¨¦tion de type V (T5SS), nos connaissances sur les subtilases restent lacunaires.
En prenant Ssp (Serratia serine protease) comme mod¨¨le de SAT (subtilase autotransporter), la d¨¦termination de sa structure tridimensionnelle a r¨¦v¨¦l¨¦ une architecture originale et distincte des autres ATs. La triade catalytique est situ¨¦e dans une poche au sommet de l'AT, le domaine catalytique N-terminal de type subtilase ¨¦tant positionn¨¦ directement au-dessus d'un domaine C-terminal ¦Â-h¨¦lico?dal. La structure de Ssp est stabilis¨¦e par trois sites de liaison au calcium et poss¨¨de un domaine autochaperon impliqu¨¦ dans son repliement. Comme indiqu¨¦ par des analyses g¨¦n¨¦tiques fonctionnelles, les trois protub¨¦rances entourant le site actif sont impliqu¨¦es dans la reconnaissance et la liaison au substrat ainsi que la cible cellulaire, et par cons¨¦quence dans l¡¯activit¨¦ cytotoxique de Ssp, mais ne sont pour autant pas n¨¦cessaires ¨¤ son internalisation.
La d¨¦termination de la structure de Ssp repr¨¦sente une avanc¨¦e significative dans la compr¨¦hension de l¡¯activit¨¦ des SATs, notamment par rapport ¨¤ l¡¯autre grande famille de prot¨¦ases chez les ATs, les SPATEs (serine protease ATs of Enterobactericeae). En plus des m¨¦canismes mol¨¦culaires sous-jacents ¨¤ la divergence fonctionnelle des ATs, ces travaux s¡¯inscrivent vers une meilleure compr¨¦hension du r?le et de la contribution respective des diverses prot¨¦ases bact¨¦riennes dans le TGI animal, humain ou d¡¯autres ¨¦cosyst¨¨mes de la cha?ne alimentaire.
R¨¦f¨¦rence de la publication :
Hor L, Pilapitiya A, McKenna JA, Panjikar S, Anderson MA, Desvaux M, Paxman JJ, Heras B. 2023. Crystal structure of a subtilisin-like autotransporter passenger domain reveals insights into its cytotoxic function. Nature Communications. 14:1163. https://doi.org/10.1038/s41467-023-36719-2
Coordonn¨¦es :
Micka?l Desvaux, UMR MEDIS (Microbiologie Environnement Digestif, Sant¨¦), INRAE-UCA, Clermont-Ferrand, France
M¨¦l : mickael.desvaux@inrae.fr
